凤凰彩票 国产“呼吸药”出海里程碑!首个中国药企吸入粉雾剂FDA批准上市

上证报中国证券网讯(章林记者徐锐)美国时间1月12日,博腾股份参股企业润生药业有限公司(以下简称“润生药业”)宣布,其自主研发的沙美特罗替卡松吸入粉雾剂(Fluticasone Propionate and Salmeterol Inhalation Powder USP,药品申请号:ANDA 214464)正式获得美国食品药品监督管理局(FDA)批准上市。这是FDA历史上首个批准的由中国药企自主研发的吸入粉雾剂(Dry Powder Inhaler,DPI),标志着国产高端复杂制剂成功叩开全球最严苛医药市场的大门。
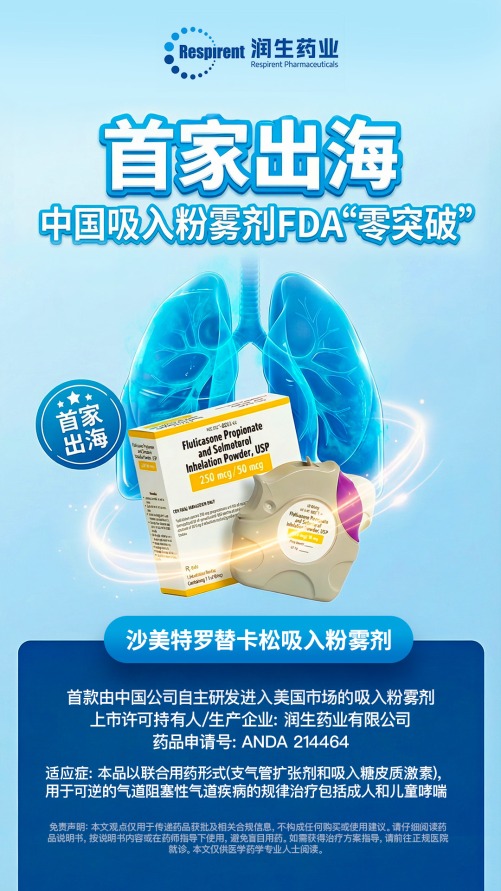
该产品以联合用药形式(支气管扩张剂与吸入糖皮质激素),用于可逆的气道阻塞性疾病的规律治疗,包括成人和儿童哮喘。其原研药Advair® Diskus®自上市25年来,据IQVIA数据,在美国年销量仍稳定在1200万盒左右,全球市场价值超百亿美元,是呼吸慢病领域的“黄金标准”药物之一。
然而,吸入粉雾剂作为典型的“药械一体”高端复杂仿制药,技术壁垒极高,长期被跨国药企垄断。其仿制面临三大难题:一是生物等效性“精度考验”:吸入粉雾剂通常剂量为“微克级”,PK-BE体内临床试验中,药物活性成分入血后的血药浓度仅为“皮克级”,要实现与原研药体内完全生物等效,对制剂配方、生产工艺的控制精度要求近乎苛刻;二是药械协同“适配难题”:疗效依赖药物与吸入装置的高度适配,装置结构、药物与辅料的聚集和分散效果直接影响药物在肺部的有效沉积率,凤凰彩票“药械一体”特性大幅提升研发复杂度与周期;三是FDA监管“严苛标准”:FDA针对此类复杂仿制药(Complex generics)颁布专属单品指南(Product-Specific Guidance,PSG),以鼓励和促进药企开展复杂制剂仿制研究,指南中对关键质量属性(CQA),如体内外生物等效研究、装置相似度等作出严苛规定,核查全面细致,抬高准入门槛。
润生药业此次获批产品严格遵循FDA复杂仿制药指南,成功攻克上述技术难关,不仅验证了其在吸入递送系统平台上的深厚积累,也为中国药企参与国际高端制剂竞争树立了技术标杆。
此次FDA批准,使润生药业成为首家跻身美国主流吸入制剂市场的中国本土企业,形成“国内医保品种+美国获批产品”双轮驱动格局。公司首款核心产品“丙酸氟替卡松吸入粉雾剂”已于2025年9月获国家药品监督管理局按化药3类独家批准上市(按化药3类独家获批);“沙美特罗替卡松吸入粉雾剂”中国上市申请亦于2025年5月提交,目前处于审评阶段。此外,公司管线还涵盖噻托溴铵、茚达特罗格隆溴铵等多个COPD/哮喘重磅吸入产品,全球化布局加速推进。
未来,润生药业将持续践行为患者提供“买得起、高质量”吸入制剂的企业使命,推进核心产品在中美等主流市场上市,惠及全球患者,提升国际行业认可度,为国产药企高端制剂出海树立标杆。

 备案号:
备案号: